2024年是龙年,也是NASH治疗药物的腾飞之年。
不出意外的话,Madrigal研发的Resmetirom将于3月14日前获FDA批准上市,开创NASH史上新的里程碑。
1月22日,Sagimet宣布Denifanstat治疗NASH的IIb期研究取得积极结果,股价暴涨170%,拥有该药大中华区权益的歌礼制药,股价在之后三个交易日累计涨幅达18%。
随着NASH治疗药物的市场价值逐渐被发现,相关公司或将迎来股价爆发期。
01
NASH领域无比火热
NASH领域是个极具吸引力的蓝海市场:患者数量庞大,治疗药物却相当稀缺。
Frost&Sullivan预计,2030年全球和中国NASH患病人数分别达4.86亿人、0.56亿人,同期全球和中国NASH市场规模将分别达到322亿美元、355亿元,市场空间相当广阔。
诱人的市场,吸引了吉利德、诺华、默沙东等MNC巨头布局。
据统计,目前全球在研的NASH药物已有上百种,靶向THR-β、FGF21、PPAR和GLP-1等近20种靶点。那些公布了积极临床数据的NASH治疗药物,更是赢得市场更高期待。
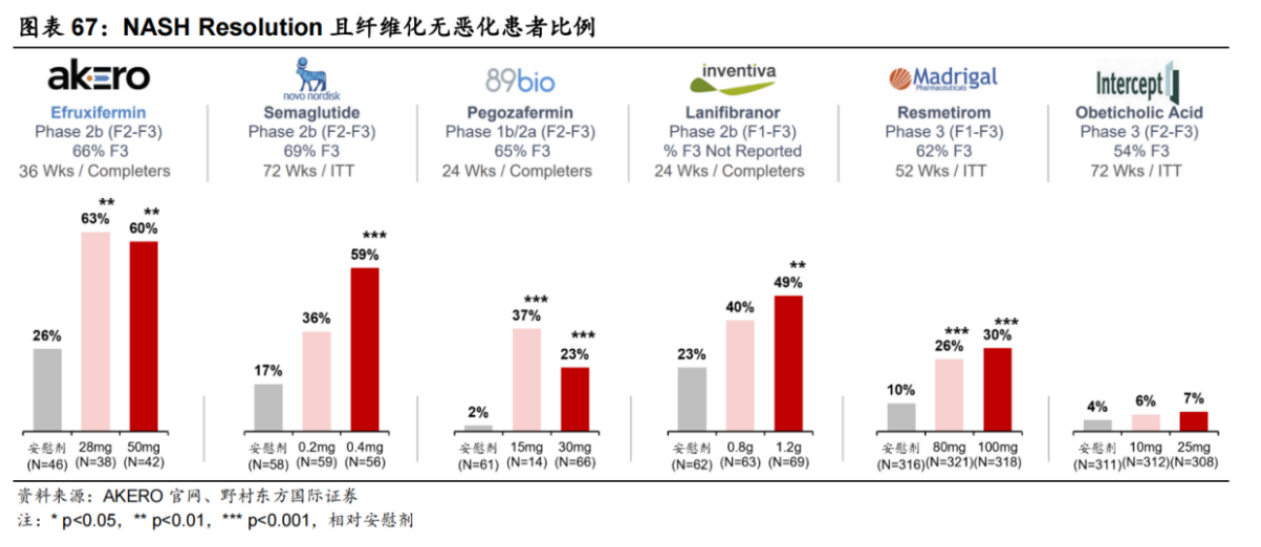
从全球研发进度看,Madrigal开发的Resmetirom,大概率将成为全球首款获FDA批准上市的NASH药物,治疗伴有肝纤维化NASH成人患者的上市申请,已获FDA受理并授予优先审评资格,预计于2024年3月14日前完成NDA审查。
NASH治疗药物之所以稀缺,除NASH发病机制复杂外,还在于FDA严格的临床终点认定:需要肝穿刺的病理学评价,影像学评价、血清学评价均不能作为上市审批的主要终点。
若要取得病理学验证的成功,药企需要证明患者用药后至少满足以下一条标准:1)患者病理学评分(NAS)改善且肝纤维化无进展;2)患者肝纤维化改善且NAS评分无恶化。
Resmetirom能获得FDA授予优先审评资格,正是基于亮眼的临床数据:采用金标准肝穿刺验证,给药52周,Resmetirom达到了NASH缓解和纤维化改善两个组织学主要终点。
根据III期试验MAESTRO-NASH结果显示:1)与安慰剂组相比(10%),在接受80mg和100mg Resmetirom治疗52周的患者中,分别有26%和30%的患者实现NASH症状缓解;2)与安慰剂组相比(14%),在接受80mg和100mg Resmetirom治疗52周的患者中,分别有24%和26%的患者实现至少一个阶段的纤维化改善,且NAS评分无恶化。
随着这一利好消息的公布,Madrigal当天股价大幅暴涨268%,收盘价从上一个交易日的63.8美元飙升至234.83美元。
无独有偶,前不久Sagimet宣布FAS抑制剂Denifanstat治疗NASH的IIb期研究取得积极结果后,股价也大幅暴涨170%。
在IIb期临床FASCINATE-2试验中,Denifanstat(地尼法司他)两大主要终点均达到了统计学显著性差异的改善,且与Resmetirom、89 Bio的Pegozafermin非头对头相比,对于NASH以及肝纤维化有更强劲的疗效,具有BIC的潜力。
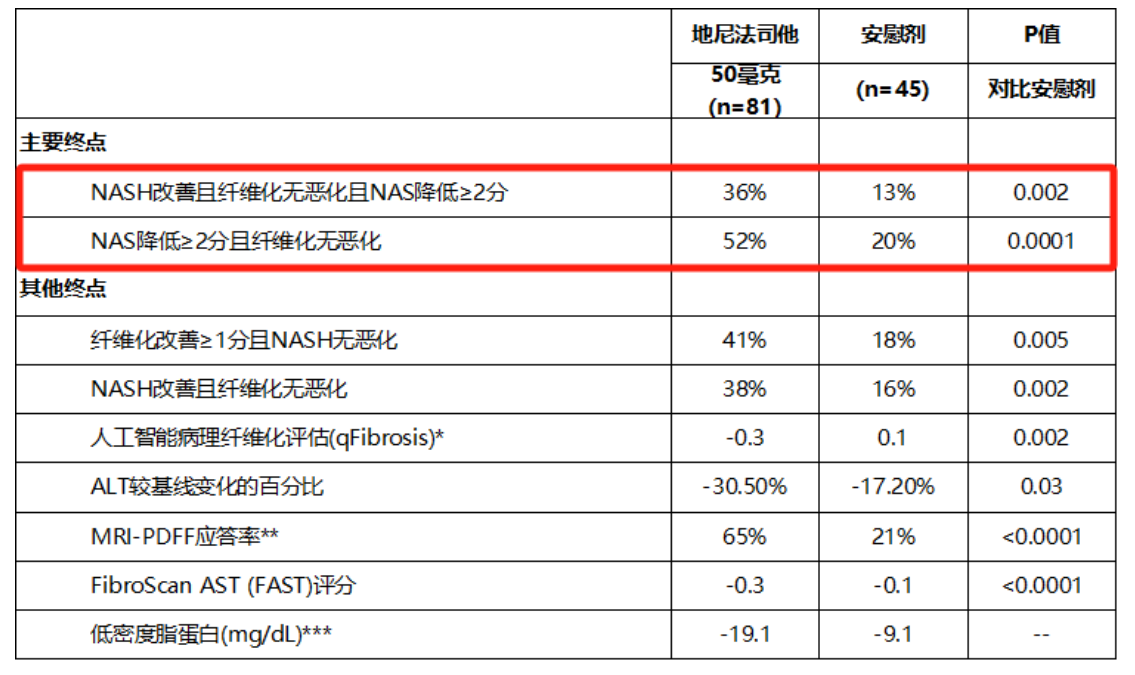
2019年,歌礼制药向Sagimet引进了Denifanstat(歌礼代号ASC40)大中华区的权益。在Denifanstat取得积极临床数据后,歌礼制药股价也随之上涨。NASH领域的火热程度可见一斑。
02
NASH药物迎来爆发期
NASH赛道的火热,不仅在于管线数量众多,更体现在研发质量上。
随着越来越多NASH治疗药物公布积极临床数据,一些靶向药物的成药性逐渐得到验证,同时也大大刺激了后来者们的研发热情。
当下针对NASH的热门靶点,包括THR-β、FGF21、PPAR和GLP-1等。其中,除THR-β抑制剂Resmetirom上市待批外,还有多种药物处于临床后期阶段,包括Akero的FGF21类似物Efruxifermin、Inventiva/中国生物制药的PPAR激动剂lanifibranor、诺和诺德的司美格鲁肽。
以THR-β激动剂为例,Viking于2023年5月宣布VK2809治疗NASH的IIb期Voyage研究达到主要终点(评估第12周患者肝脏脂肪含量的变化)——VK2809组肝脏脂肪含量至少降低30%的患者比例最高达84.9%,次要终点为第52周肝活检的组织学情况和肝纤维化无恶化的患者比例,预计2024年上半年读出肝穿数据。
FGF21类似物方面,Akero开发的Efruxifermin进度领先,已于2023年12月率先启动Ⅲ期试验,预计2026年4月可完成主要研究;89Bio的Pegozafermin紧随其后,已公布积极临床IIb期数据,预计2024年启动Ⅲ期研究。
根据IIb期研究显示,Efruxifermin的两个剂量组药物均达到了改善肝脏纤维化的主要终点和多个次要终点,且肝穿刺数据亮眼。在剔除安慰剂组效应后,Efruxifermin在上述两个终点均展现出同类最佳疗效。
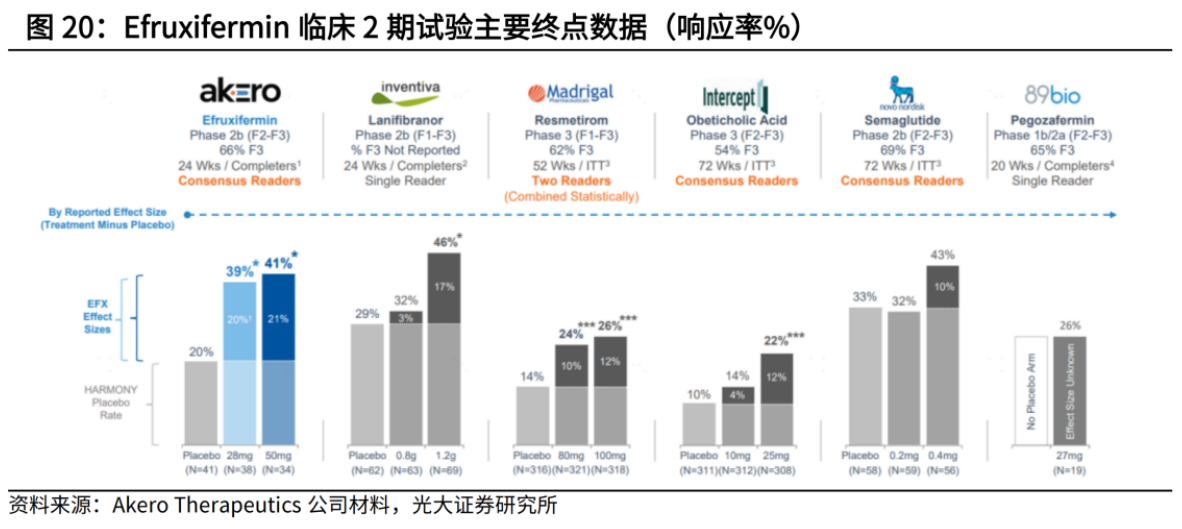
PPAR激动剂也颇有看头,进度最快的是中国生物制药子公司正大天晴向Inventiva引进的Lanifibranor。
Lanifibranor是一种口服泛PPAR激动剂,能够靶向所有三种PPAR亚型,此前在IIb期NATIVE试验中显示出良好的安全性和耐受性,显著降低了肥胖且经活检证实为NASH患者的SAF-A(脂肪变性、活动性、纤维化的活动度)评分,且达到了多个次要终点。
此前,Inventiva启动了Lanifibranor治疗NASH的III期NATiV3研究,预计2025年9月完成,如果顺利取得积极临床数据,或将于2026年上半年向FDA申请加速批准。
除糖尿病、减重适应症外,GLP-1类药物也大举进军NASH领域。其中,诺和诺德司美格鲁肽已开展III期研究,预计2028年可揭晓结果;礼来替尔泊肽已处于II期临床,预计2024年上半年完成主要研究。
综上可见,许多处于临床后期阶段的NASH药物基本在2024年读出重要数据,或在未来几年完成关键III期研究。这意味着,NASH药物即将迎来爆发期。
03
国产药企的机遇
在这场属于NASH药物的盛宴中,国产药企也紧紧抓住机遇,包括中国生物制药、歌礼制药、海思科、众生药业,以及“卖水人”福瑞股份等。
中国生物制药主要采取引进策略,除Lanifibranor外,还向安源医药引进了治疗NASH和Ⅱ型糖尿病的新型生物药AP025和AP026。其中,FGF21类似物AP025,与Akero开发的Efruxifermin靶点相同,正在开展II期临床,AP026是一款FGF21R/GLP-1R双靶点抗体类融合蛋白。
Lanifibranor进度最快,中国生物制药加入了NATiV3全球III期临床研究并在中国入组患者,预计2026年上半年在中国递交NDA。根据IIb期24周随访数据显示,Lanifibranor非头对头对比其他口服药(Ocaliva、Resmetirom)具有疗效优势、对比注射类药物(Efruxifermin、Pegozafermin、Semaglutide)疗效可比并具有给药便捷的优势。
另外,根据Inventiva演示材料,III期临床试验计划入组950例无纤维化及纤维化F2-F3期的NASH患者,以NASH改善和纤维化改善为主要临床终点随访72周寻求附条件审批,且试验期间仅需要2次肝穿刺,相较其他NASH治疗药物3次活检具有一定入组优势。
歌礼制药布局了ASC40、ASC41,以及THRβ/FXR双靶点固定剂量复方制剂ASC43F。其中,ASC40(Denifanstat,地尼法司他)引进自Sagimet,后者已于1月22日宣布治疗肝穿活检F2/3期NASH的IIb期临床取得积极顶线结果。
ASC41同Resmetirom、VK2809一样,都属于THR-β激动剂,歌礼制药于1月2日发布公告称,ASC41片治疗经肝穿活检证实的NASH患者52周Ⅱ期临床试验取得积极期中结果,患者服用ASC41片12周后,肝脏脂肪含量较基线的相对降幅平均值高达68.2%。期待报告这项研究第52周肝穿活检组织学评估结果。
海思科研发的HSK31679也属于THR-β激动剂,已于2023年3月获NMPA批准开展Ⅱ期临床试验,针对治疗高胆固醇血症合并非酒精性脂肪性肝病患者。
值得一提的是,在NASH领域无比火热的当下,肝穿病理组织活检这个NASH诊断的金标准市场价值被不断释放。这也让福瑞股份“卖水人”的逻辑不断加强。
此前,福瑞股份收购了全球领先的专注无创慢性肝病的诊断仪器的供应商——Echosens,后者拥有按次收费模式的肝病无创检测设备FibroScan。
FibroScan可用于定量检测肝脏纤维化和脂肪变性,是全球公认的肝纤维化和肝脏变性评估的参考标准,也是第一个经过临床验证的用于肝脏硬度定量测量的设备,已获得欧盟CE、美国FDA和中国NMPA等认证,有望成为下一代无创NASH检测的金标准、作为肝活检的有效替代。
截至2022年末,福瑞股份已与辉瑞、诺和诺德、吉利德等巨头合作,也牵手了Madrigal、Akero等头部NASH研发公司,未来随着NASH治疗药物的上市,有望拉动FibroScan的销售,相关检测和筛查的需求也有望快速释放。
结语:随着越来越多NASH治疗药物公布积极临床数据,全球进入了NASH治疗药物市场规模放大的加速时期。







发表评论 取消回复