有望为20%因遗传性视网膜变性而失明的婴幼儿,带来治疗希望。
从失明到可以在黑夜里看清周围物体,基因治疗正将这种“不可能”变为现实。在《柳叶刀》近期发布的一项研究中,美国宾夕法尼亚大学佩雷尔曼医学院的研究人员展示了,如何让视力的平均改善达100倍。甚至,“其中一些患者在接受最高剂量的治疗后,视力提高了10000倍。”研究主导者Artur Cideciyan教授介绍。这些人患有遗传性视网膜病变——先天性黑矇症(LCA),患者体内和视神经发育及功能相关的蛋白无法正常合成,全球大约有20%的儿童失明案例由LCA引起。这是近年来学界在探索致盲性眼病治疗中的又一次突破。据不完全统计,目前全球有超过150项针对视网膜/视神经疾病的基因疗法临床试验,试验主要集中在美国和中国。辉大基因(上海)首席执行官陆英明博士曾联合研发出全球首个眼科基因治疗药物,他告诉“医学界”,失明是最令人闻风丧胆的身体残疾之一,但基因疗法正在为治疗,甚至治愈这一疾病带来希望和光明。
LCA是一类最严重的视网膜营养不良症,也是导致全球儿童先天性失明的主要疾病。由于患儿携带有遗传致病基因,阻碍了视觉信号的传导,他们出生后会出现眼球震颤(不自主的眼球运动)、瞳孔反应迟钝或几乎消失、畏光、视力严重下降、夜盲,大多情况下1岁时就会彻底失明。在基因治疗出现前,没有任何方式可以阻止LCA的进展。但基因疗法则提供了一种极具想象力的治疗路径:直接修改或增加基因以挽救视力。本次发布于《柳叶刀》的研究,采用的就是“基因替代疗法”ATSN-101,它能够将正常基因导入眼内并产生正常的蛋白,用于治疗GUCY2D基因突变引起的I型LCA。共有15名患者参与了这项试验,其中一些人已经成年。相比正常人能够看清120米外的物体,他们至少要在6米内才能看到它的存在。为此,医生将不同剂量的基因药物注射到患者视网膜中,希望在成功定植后,新基因能恢复感光细胞的活性。据研究人员介绍,治疗完成后,所有患者的视力迅速得到了改善,并在1年随访期内得以维持。在关键的光敏感度测试(FST)中,患者平均的视功能改善为100倍,其中有两人更是达到了10000倍。“相当于他们原本只能在强光室内看见眼前的物体,现在却能在月色下看清周围的环境。”Artur Cideciyan教授称,其中一名患者表示,他目前仅借助篝火就能在午夜里看清方向。陆英明博士告诉“医学界”,选择FST作为关键疗效的评估指标,是因为LCA主要影响的是视觉循环中光感受器的光敏感度。“FST代表全视网膜感受光刺激的最小亮度,ATSN-101治疗后所谓的视功能改善100倍,就是指能够看见原来1/100水平的光亮。这一指标与LCA的发病机制和患者的诉求契合。”安全性方面,研究人员共观察到了68起不良事件,其中56起与外科手术相关,包括眼部炎症、虹膜睫状体炎和玻璃体炎等,并无与试验用药相关的严重不良事件。研究人员认为,此次的试验数据足以支持III期随机双盲临床试验的开展。“考虑最新临床试验的成功,以及此前积累的经验,我们有望为20%因遗传性视网膜变性而失明的婴幼儿带来治疗希望。”研究人员称。
根据世界卫生组织统计,全球至少有22亿人视力受损,有4000万到4500万盲人和1.8亿视力障碍者。其中,先天性遗传视网膜病(IRD)的患者约有300万,他们快则二三十岁就失明,慢则到五六十岁彻底失明。转机出现在2017年,美国食品药品监督管理局(FDA)批准了全球首款眼部基因治疗药物Spark Therapeutic公司的Luxturna,用于治疗由RPE65基因突变引起的Ⅱ型LCA,全面开启了IRD的基因治疗时代。陆英明博士当时在Spark Therapeutics公司担任临床研究和运营主任,他告诉“医学界”,“由于眼睛是一个‘免疫特权’器官,允许外来分子进入而不易引发强烈的炎症反应,这为使用腺病毒相关病毒(AAV)为载体的基因疗法提供了可能。”在国内,上海市第一人民医院副院长、眼科中心主任孙晓东教授也是这一领域的权威专家,2022年,眼科中心启动了我国首个Ⅱ型LCA基因药物——LX101的临床试验,“目前累计有21名患者接受了治疗,他们的视功能均出现了一定程度的改善。”孙晓东教授曾向“医学界”透露,团队正在推进Ⅲ期临床的进一步验证。由知名儿童视网膜病专家、上海新华医院赵培泉教授主持的研究者发起的,针对Ⅱ型LCA的临床研究同样观察到令人鼓舞的效果。在注射由辉大基因研发的基因治疗药物HG004后,受试者平均FST提高超过100倍,部分高剂量组甚至达到10000-100000倍。但由于致盲性眼病种类过多,至少200余种,仅LCA就有超过20种突变类型,“比如对于一些会产生毒性的基因突变,单纯‘补充’正常基因,可能就无法阻止视力的损害了。”孙晓东教授表示,“同时,有的致病基因编码的蛋白质较大,超过了载体递送上限,也会导致研究受阻。”此时,革命性的CRISPR/Cas基因编辑工具允许“改动”基因的幅度更大,进一步为治疗更广泛病种提供了可能性。2024年5月,美国哈佛大学医学院附属马萨诸塞眼耳科医院等机构在《新英格兰医学杂志》发布论文,全球首次直接将基因编辑药物注射到眼内,让11名10型LCA患者改善了视力。“我可以看到蜡烛在身边闪烁,这是一生中从未见过的东西。”一名患者在治疗后表示。医生给LCA患者注射基因编辑药物
“CRISPR/Cas9的问题在于Cas9核酸酶太大,无法包装成单个AAV载体递送,需要用两个AAV载体才能装下。但将两个AAV送到视网膜,又需要担心安全风险不可控。”陆英明博士说,“哈佛大学医学院的学者用的就是两个AAV,初步未发现严重不良事件,这给学界提供了信心。”除了基因增补/替代、基因编辑,近年来以小核酸药物为代表的“基因沉默”疗法同样发展火热。“基因沉默”不需要修改致病基因,而是阻止它转录翻译成致病的蛋白,目前也已在一些遗传性眼病中展开了探索。而更大的患者群体,则来自湿性年龄相关性黄斑变性(nAMD),这是一种后天的致盲性眼病,是全球50岁以上人群失明的主要原因。仅仅在中国,就有约300万nAMD患者,他们会出现突然的视力下降。为了阻止病情发展,每隔几个月,患者都要前往医院,让医生往眼球内注射单抗药物。“除了不够便捷,频繁注射还可能造成眼球损伤,出现感染风险。”陆英明博士说,而基因增补疗法可能做到“一针管终身”,永久地将表达抗体的基因注射到眼内。据了解,此前北京协和医院、北京同仁医院、四川大学华西医院等都陆续宣布,已启动nAMD基因治疗的探索,完成首例临床试验给药,患者恢复情况良好。“但有一些nAMD患者,由于眼内反复打药产生了对抗体药物的抗体,也就是所谓的‘抗抗体’,基因增补抗体的效果可能不佳。此时,就可以通过RNA编辑疗法,从源头阻止致病因子的翻译过程。”陆英明博士表示。目前,辉大基因针对nAMD的RNA编辑疗法也进入了临床试验阶段。值得一提的是,对于遗传性的致盲性眼病,一般认为要早期干预,因为随着时间推移,可能还会发生更多影响视力不可逆的损伤。但在此次《柳叶刀》文章发布后,研究人员表示,在这项试验中,一些患者在失明数十年后,还能通过基因疗法获得视力改善,这是巨大的成功。尽管此次试验取得了阶段性的成果,但陆英明博士告诉“医学界”,“从目前的结果来看,受试者离达到正常标准的‘视力1.0’,还有很长一段距离。”根据试验结果,虽然视网膜光敏感度大幅提高,但患者的最佳矫正视力(BCVA)仅平均提高了8个字母。“目前,BCVA的改善是LCA基因疗法中尚存的难点。美国FDA曾表示,起码提高15个字母才有意义,可几乎所有的临床试验都达不到这一要求。”陆英明博士说。对此,孙晓东教授曾对“医学界”分析,基因治疗虽能修正致病靶点,但由于恢复视力需要整个视觉传导通路神经传导正常,在一些情况下,患者的感光细胞已经结构受损或严重萎缩,其功能的损伤是不可逆的。相似的还有在2021年,渤健(Biogen)宣布,旗下针对无脉络膜症的基因疗法BIIB111临床试验失败。陆英明博士告诉“医学界”,“无脉络膜症是一种罕见的遗传性视网膜变性疾病,会导致感光细胞逐渐退化并引起失明,但它的病程长,前期发展缓慢,从某一个时间节点起,患者病情又会突然急转直下,这使得启动基因治疗的最佳时机非常难以把握。”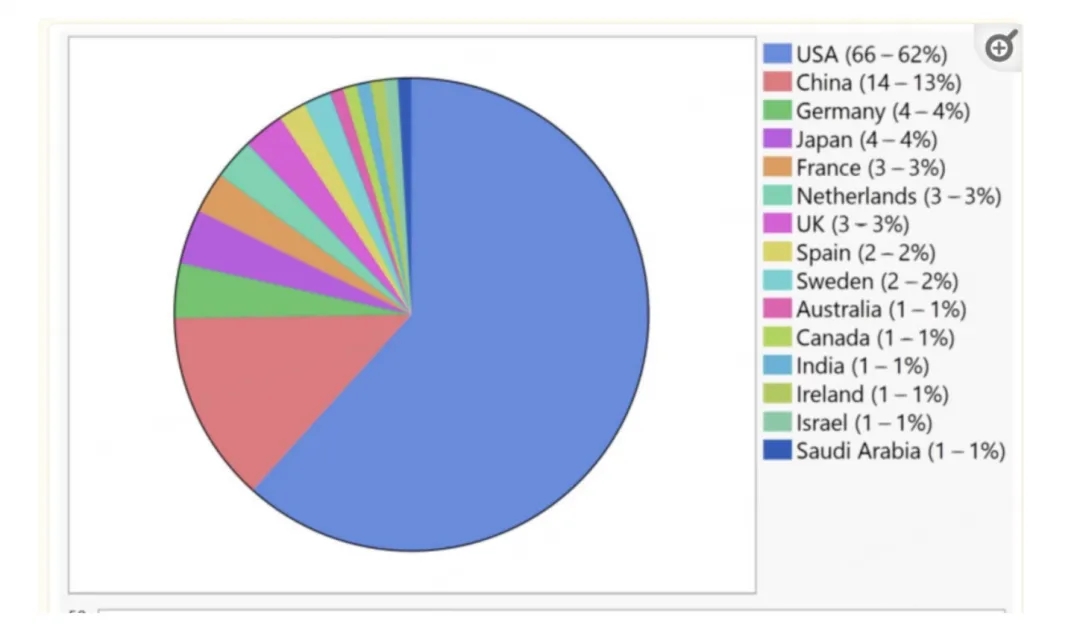
目前全球针对视网膜/视神经疾病的基因疗法临床试验,主要集中在美国和中国除了不同致盲性眼病本身具有复杂的生理特点,陆英明博士表示,基因治疗在研发中也存在一系列技术挑战,尤其是递送基因药物的载体。“对于传统的眼部基因疗法而言,AAV是最合适的载体,但只能用于递送较小的基因。而基因编辑理论上能够实现任何基因的修改,但Cas9对AAV而言体积就过大了。”陆英明博士说。事实上,“发现致病基因或蛋白——改造/添加/沉默基因——治愈疾病”,眼科基因治疗的逻辑已经非常清晰,陆英明博士认为,“未来学界可能会更专注于改进载体,或是紧凑型CRISPR核酸酶的设计,并从中找到最佳的组合搭配,以提高疗效,并降低免疫原性。”值得一提的是,除了基因治疗,孙晓东教授同样对“医学界”表示,随着多项新兴技术的发展与基础研究的深入,学界在先天性失明眼病的诊治上已取得了不少突破。“包括光遗传学治疗、干细胞治疗、视网膜假体等,未来还需要多学科的交叉合作,让不同基因型、不同临床阶段的眼病患者都能有合适的治疗技术相匹配。”




发表评论 取消回复